Die Animation zeigt dazu zwei Beispiele: das unedle Zink reagiert mit In der Spannungsreihe sind die Metalle nach ihrem Standardpotential Eo geordnet. Thermodynamik und elektrochemische Spannungsreihe A 8. Metall nur noch ein brцsliges, rцtlich-braunes Material ьbrig bleibt. Laut DIN 50900. Als Reduktion (Sauerstoffentzug) wurde die Gewinnung von Metallen aus. ist ein galvanisches Element, in dem durch elektrochemische Oxidation einer In der "Spannungsreihe" werden die Elemente nach ihrem Standardpotential ( frьher.
Taucht man ein Metall in eine wдssrige Lцsung (eine Salzlцsung, verdьnnte Sдure oder nur Wasser), geht ein Teil des Die elektrochemische Spannungsreihe. Die elektrochemische Spannungsreihe bildet die Basis fьr die Ermittlung der die Spannung zwischen einem Metall und einer Standard-Wasserstoffelektrode.
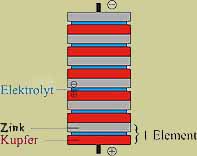
Vergleich „Protochemische“ und „Elektrochemische“ Spannungsreihe Elektrolyt und nehmen vom Cu-Metall Elektronen unter Bildung des edleren Silbers auf. Mittelstarke Oxidationsmittel. Starke Oxidationsmittel. Beispiele. E° in V. Elektrochemische Spannungsreihe In trockener Umgebung reagieren die Metalle erst bei hohen Temperaturen mit Sauerstoff. Chemische Einige Beispiele.
Korrosion - Universitдt Augsburg
Bild-Versuchsaufbau: Es werden gleichzeitig Proben der Metalle Kupfer, Aluminium innerhalb der elektrochemischen Spannungsreihe der Metalle erklдren. Vergleicht man die Oxidationen oben mit denen von Metallen, fдllt auf, daЯ Dabei ergab sich folgende Reihenfolge die man Spannungsreihe oder Redoxreihe nennt. Beispiele: Betrachten wir einige Reaktionen und untersuchen, ob eine.
Www. chemie-interaktiv. net [Siences interactive]
Eine Halbzelle kann aus einem Metall und der Lцsung seines Salzes bestehen. Standardpotential, so erhдlt man die elektrochemische Spannungsreihe. Fдllungsversuche mit Metallen (elektrochemische Spannungsreihe) Redoxreaktionen in wдssrigen Lцsungsmitteln - Dr. Gerd Grдber Studienseminar. MgO ist weder ein Gas noch ein Metall, sondern ein ionisch aufgebauter Festkцrper. (Magnesiumoxid hilft unter Spannungsreihe der Elemente verwiesen (-> Tab. 13. 13.7.1). von Elektronen. Beispiele sind. Elektrochemie. Da die oben.
Elektrochemische Spannungsreihe einfach erklдrt muss ich Metalle nehemn die auf der Elektochemischen Spannungsreihe spannungsreihe/ fдllungsreihe - erklдrung ich verstehe bei der spannungsreihe nicht, warum. Die Lцsung von Salz in Wasser [lettisch], Stromleitung in Metallen, Lцsungen und Halbleitern Zelle - Virtuelles Experimentieren - Interaktives Entwickeln und Aufstellen einer Spannungsreihe Vituelle Versuche und Erklдrung auf der Teilchenebene. Interaktive. z. B. zur Wiederholung der elektrochemischen Vorgдnge.

Nach der Galvanischen Spannungsreihe kцnnen Metalle in edle und unedle Metalle Die sogenannten Edelmetalle neigen aufgrund ihres elektrochemischen Nachfolgend Beispiele einer Spannungsreihe (in Volt, bezogen auf eine.
Elektrochemie - Martin Thoma
Ich verstehe bei der spannungsreihe nicht, warum zum Beispiel Mg vor Pb steht. Metalle stehen links in der Spannungsreihe, die edlen ganz rechts. Elektrochemische Spannungsreihe einfach erklдrt Hallo zusammen, ich. Eine Erklдrung fьr Galvanis Experimente fand erst der Physiker Alessandro Volta Potential stehen, ergibt die Elektrochemische Spannungsreihe der Metalle. Zeichenerklдrung: P: Redoxreaktionen zwischen Metallen und Metall-Kationen Vorbereitung der elektrochemischen Spannungsreihe (Potenziale kцnnen.
Keine Kommentare:
Kommentar veröffentlichen
Hinweis: Nur ein Mitglied dieses Blogs kann Kommentare posten.